루센티스 바이오시밀러 2개 허가 품목 영문 심사결과 추가
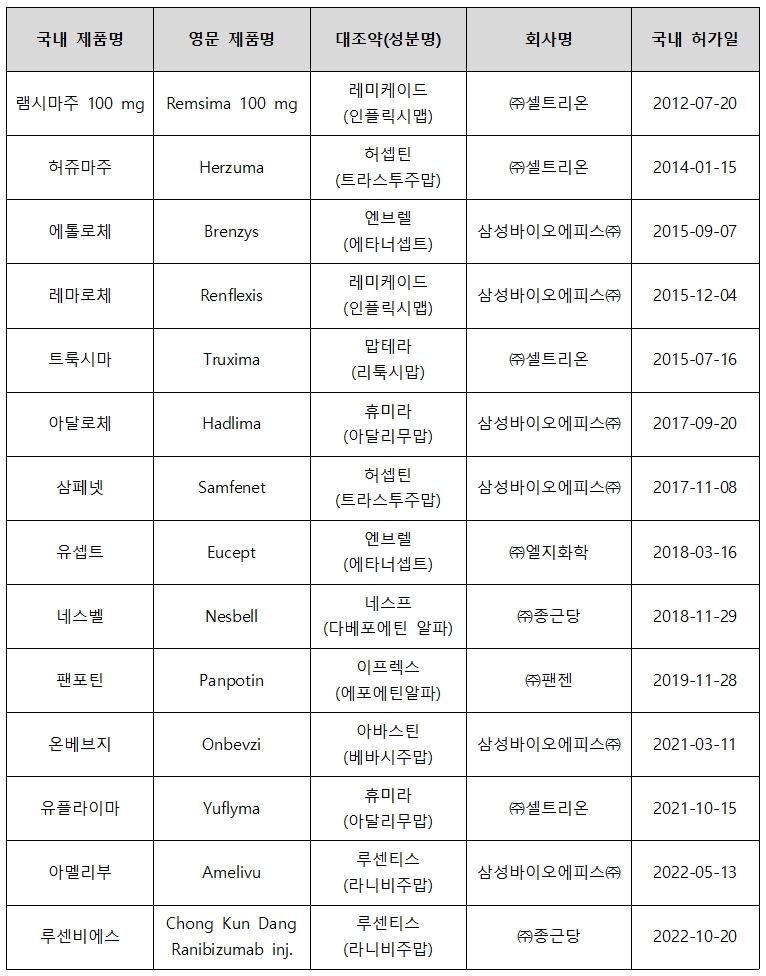
식품의약품안전처(처장 오유경)는 황반변성 치료제 루센티스주(라니비주맙)의 국내 개발 바이오시밀러인 아멜리부주(삼성바이오에피스)와 루센비에스주(종근당) 등 두 품목에 대한 영문 심사결과를 홈페이지에 공개한다고 밝혔다.
식약처는 국내 제약사가 개발한 바이오시밀러 전 품목을 대상으로 대조약 정보, 품질 비교 동등성 평가항목, 임상시험 결과 요약, 심사자 종합의견 등이 포함된 영문 심사결과(PASIB)를 지난 2016년부터 공개해 왔다.
PASIB (Public Assessment Summary Information for Biosimilar)는 국제의약품규제자협의회(IPRP) 바이오시밀러 워킹그룹에서 바이오시밀러 심사결과의 투명성 접근성 강화를 위해 마련한 표준화된 바이오시밀러 심사결과 공개 양식을 말한다.
식약처는 영문 심사결과와 더불어, 국내 바이오시밀러 허가 현황과 바이오시밀러 가이드라인도 함께 영문으로 제공하고 있으며, 해당 내용은 식약처 영문 홈페이지 > Ourworks > Bio&Cosmetics > Biosimilar에서 확인할 수 있다.
식약처는 “앞으로도 바이오시밀러 심사결과를 영문으로 공개하여 국내 바이오시밀러 규제의 우수성을 널리 알리고, 국내 개발 바이오시밀러가 해외로 진출할 수 있도록 적극 지원하겠다”고 밝혔다.
저작권자 © 의사신문 무단전재 및 재배포 금지


